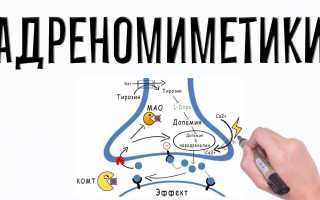
Механизм действия и фармакологические эффекты
В результате стимуляции центральных а2-адренорецепторов, вызываемой ЛС этой группы и, в частности, клонидином, происходит угнетение вазомоторного центра, уменьшение симпатической импульсации из ЦНС и подавление активности адренергических систем на периферии. Результирующим эффектом является уменьшение ОПС и в меньшей степени СВ, что проявляется снижением АД. Агонисты альфа2-адренорецепторов урежает ЧСС и уменьшает выраженность барорецепторного рефлекса, направленного на компенсацию снижения АД, что является дополнительным механизмом развития брадикардии. Клонидин уменьшает образование и содержание ренина в плазме крови, что также вносит свой вклад в развитие гипотензивного эффекта при длительном приеме. Несмотря на снижение АД, уровень почечного кровотока не изменяется. При длительном применении клонидин вызывает задержку в организме натрия и воды и увеличение ОЦП, что является одной из причин снижения его эффективности.
В больших дозах агонисты альфа2-адренорецепторов активируют периферические пресинаптические а2-адренорецепторы в окончаниях адренергических нейронов, через которые осуществляется регуляция высвобождения норадреналина на основе отрицательной обратной связи и таким образом вызывает кратковременное повышение АД за счет сужения сосудов. В терапевтических дозах прессорное действие клонидина не выявляется, но при передозировке может развиться выраженная гипертензия.
В отличие от ГГБ и фентоламина клонидин снижает АД, не вызывая выраженной постуральной реакции. Клонидин вызывает также понижение внутриглазного давления за счет уменьшения секреции и улучшения оттока водянистой влаги.
Фармакологические эффекты альфа2-адренергических агонистов не ограничиваются антигипертензивным действием. Клонидин и дексмедетомидин используются также в связи с их отчетливыми седативным, анксиолитическим и анальгетическим свойствами. Седативный эффект связывают с депрессией основного адренергического ядра головного мозга — locus ceruleus в области ромбовидной ямки продолговатого мозга. В результате подавления аденилатциклазного и протеинкиназного механизмов уменьшается нейрональная импульсация и выброс нейротрансмиттеров.
Клонидин оказывает выраженный седативный эффект и подавляет гемодинамическую реакцию организма на стресс (например, гипердинамическую реакцию на интубацию, травматичный этап операции, пробуждение и экстубацию больного). Проявляя седативный эффект и потенцируя действие анестетиков, клонидин не оказывает существенного влияния на картину ЭЭГ (что очень важно во время операций на брахиоцефальных артериях).
Хотя собственная анальгетическая активность клонидина недостаточна для достижения периоперационной аналгезии, ЛС способно потенцировать действие общих анестетиков и наркотических веществ, особенно при интратекальном его введении. Этот положительный эффект позволяет существенно уменьшить используемые во время общей анестезии дозы анестетиков и наркотических ЛС. Важной особенностью клонидина является его способность уменьшать соматовегетативные проявления опиатной и алкогольной абстиненции, что, вероятно, также обусловлено снижением центральной адренергической активности.
Клонидин увеличивает длительность региональной анестезии, а также оказывает прямое влияние на постсинаптические альфа2-рецепторы задних рогов спинного мозга.
Анальгетическое действие альфа2-агонистов наиболее ярко проявляется при эпидуральном или субарахноидальном введении (Sabbe et al., 1994). При системном введении альфа2-агонисты также проявляют анальгетическую активность, но зачастую бывает трудно отличить истинную анальгезию от невозможности ответить на болевой стимул.
Повышенное периферическое сопротивление увеличивает постнагрузку на миокард и может усугубить регургитацию у животных с эндокардиозом митрального клапана (Pascoe, 2009). Кроме того у собак альфа2-адреноагонисты часто вызывают атриовентрикулярние блокады 1 и 2 степени (Haskins et al., 1986), также сообщалось о случаях желудочковой экстрасистолии (Moens and Fargetton, 1990). У кошек по данным Lamont et al. (2001), медетомидин приводит к снижению сократимости и сердечного выброса, и одновременному повышению периферического сосудистого сопротивления и центрального венозного давления; при этом артериальное давление, рН, напряжение кислорода и диоксида углерода не меняется. По мнению этих же авторов применение альфа2-агонистов может играть положительную роль у животных с гипертрофической кардиомиопатией и обструкцией выносящего тракта левого желудочка (Lamont et al., 2002).
Альфа2-агонисты могут вызывать депрессию дыхания, степень которой сильно варьирует и зависит как от дозы препарата, так и от одновременного применения других препаратов. В некоторых случаях гиповентиляция может стать выраженной. У собак после болюсного внутривенного введения медетомидина или дексмедетомидина может наблюдаться кратковременное апноэ и небольшой цианоз, что обычно не сопровождается выраженной гипоксемией (Kuusela et al., 2000). Введение кетамина собакам, предварительно получившим ксилазин может приводить к выраженной гиповентиляции и снижению рН артериальной крови на фоне дыхательного ацидоза (Haskins et al., 1986). Гипоксемия на фоне применения альфа2-агонистов является нередким осложнением у овец и особенно сильно проявляется при бысторм внутривенном введении препарата; также у этого вида животных нередки случаи развития отека легких при использовании альфа2-агонистов (Kästner, 2006).
Haskins et al. (1989), среди прочих эффектов альфа2-агонистов отмечают уменьшение мертвого пространства, снижение легочного сопротивления и увеличение дыхательного объема; однако транспорт О2 к тканям по данным этих авторов снижается. Benson et al. (1985), анализируя причины необъяснимой гибели собак после анестезии на основе ксилазина с кетамином предполагают, что снижение тканевой перфузии лежит в основе фатальных изменений.
К прочим побочным эффектам альфа-2-адреноагонистов относятся: гипергликемия, гипотермия, рвота, полиурия, снижение моторной и секреторной функции ЖКТ, уменьшение саливации, снижение внутриглазного давления, мидриаз, повышение агрегации тромбоцитов, снижение синтеза стероидных гормонов. Гипергликемия является следствием прямого угнетения выработки инсулина бета-клетками островков Лангергаганса поджелудочной железы, степень ее зависит от дозы. Полиурия связана с угнетением выработки антидиуретического гормона и увеличением клубочковой фильтрации (Adams 1). По мнению Pascoe (2009), этот эффект может играть негативную роль у гиповолемичных животных, однако данных об этом пока на достаточно. Рвота является нередким осложнением у собак и особенно у кошек, которое наблюдается как правило после внутримышечного введения альфа2-агониста (Vainio, 1989; Haskins et al., 1986;). У собак через несколько часов после применения ксилазина может развиваться острое расширение желудка, особенно склонны к этому некоторые породы, среди которых бассет, немецкий дог и сеттеры. Повышенное скопление газов в желудке и кишечнике может мешать интерпретации результатов различных диагностических исследований (Adams, 2001).
При эпидуральном и субарахноидальном введении альфа2-агонистов развивается анальгезия, опосредованная активацией пресинаптических и постсинаптических альфа2-адренорецепторов расположенных в дорсальных рогах спинного мозга. По данным Campagnol et al. (2007), эпидуральное введение дексмедетомидина собакам дает дополнительный анальгетический эффект, в результате чего снижается минимальная альвеолярная концентрация изофлюрана. Rector et al. (1997), показали, что эпидуральное введение ксилазина собакам в большей степени снижает ответ на соматическую болевую стимуляцию, чем ответ на висцеральную стимуляцию. Однако зачастую при эпидуральном введении альфа2-агонистов наблюдаются те же негативные кардио-респираторные эффекты, что и при системном введении. Vesal et al. (1996), показали что у собак, послеоперационная анальгезия после эпидурального введения медетомидина сравнима с таковой после эпидурального введения оксиморфона, но сопровождается брадикардией, у некоторых животных наблюдается атрио-вентрикулярная блокада 2 степени. В другом исследовании у собак добавление медетомидина к морфину лишь незначительно улучшало качество эпидуральной анальгезии после операций в области коленного сустава по сравнению с одним морфином (Pacharinsak, 2003). Таким образом, место альфа2-агонистов в качестве препаратов для эпидуральной/субарахноидальной анестезии/анальгезии пока еще не определено.
Продолжительность действия различных альфа2-агонистов варьирует, тем не менее все они оказывают довольно длительный эффект. Однако, действие альфа2-агонистов может быть прекращено введением специфических антагонистов альфа2-адренорецепторов, таких как атипамезол и йохимбин, которые приводят к быстрой реверсии кардио-респираторных эффектов, однако они также устраняют седацию и анальгезию. Йохимбин является менее избирательным и менее специфичным альфа2-антагонистом и его применение часто вызывает возбуждение, поэтому применение более избирательного и высокоспецифичного атипамезола считается предпочтительным (Lammintausta, 1991). Возможно, что скоро в клинической практике появятся альфа2-антагонисты нового поколения, не проникающие через ГЭБ и оказывающие только периферическое действие. Недавнее исследование продемонстрировало, что эти препараты способны уменьшать негативное влияние дексмедетомидина на сердечно-сосудистую систему, не оказывая значительного влияния на уровень седации (Honkavaara et al., 2009).
Согласно инструкциям к препаратам относящимся к группе альфа2-адреноагонистов, применение их у животных с заболеваниями сердечно-сосудистой системы противопоказано. Это однако не согласуется с тем, что в гуманной медицине эти препараты исследовались именно на кардиологических больных. У людей активно велось изучение трех препаратов – клонидина, мивазерола и дексмедетомидина. Основное внимание уделялось кардиопротекторным свойствам альфа2-агонистов. Так, несколько исследований показали, что пациенты, принимавшие в предоперационном периоде клонидин, реже подвергались ишемии миокарда. Другое исследование, в котором пациенты продолжали получать препарат во время операции и в течение нескольких дней после, 30-дневная и 2-летняя выживаемость в группе клонидина была выше по сравнению с плацебо. Ряд исследований показал, что периоперационная инфузия мевазерола у пациентов ИБС не только снижает частоту возникновение ишемии миокарда, но и уменьшает количество осложнений и улучшает исход в послеоперационном периоде. Инфузия дексмедетомидина во время хирургического вмешательства помогает избежать эпизодов тахикардии и повышения АД, но при этом как правило увеличивается объем инфузии и количество вазопрессоров (Fleisher, 2009). В связи с неоднозначностью действия альфа2-агонистов считается, что они не должны применяться (или применяться с осторожностью) у животных с серьезными системными заболеваниями. Возможно, что с появлением новых научных данных эта позиция будет пересмотрена.
Агонисты альфа2-адренорецепторов порядка 40 лет разрешены для ветеринарного применения в странах ЕС, Канада, США, хотя первые родоначальники этого класса использовались в медицине в качестве препаратов для лечения гипертонии и патологий ЦНС. Для агонистов альфа-2-адренорецепторов были открыты такие клинические эффекты как анальгезия, анксиолизис, седация, миорелаксация, которые легли в основу их последующего широкого применения в ветеринарии как для иммобилизации диких экзотических животных [4,7], так и в хирургии домашних животных [14,16,17,20,22]. Помимо указанных клинических эффектов, введение ксилазина или медетомидина приводит к значительному уменьшению количества инъекционной и ингаляционной анестезии, необходимой для индукции и поддержания анестезии. Агонисты альфа2-адренорецепторов также ослабляют реакцию стресса при травме, снижая уровень катехоламинов и кортизола в крови после операции [3,11,20]. Достаточно подробно описаны негативные клинические эффекты для агонистов альфа2-адренорецепторов у различных видов животных. В связи с этим применение их имеет ограничение у пожилых животных, у пациентов, имеющих в анамнезе проблемы со стороны сердечно-сосудистой системы.
Медетомидин и ксилазин – наиболее часто используемые агонисты альфа2-адренорецепторов в хирургической и анестезиологической практике в России у мелких домашних животных, поэтому изучение клинических эффектов воздействия их на организм животных представляется интересным.
Целями данного исследования были определить и оценить основные клинические эффекты, наблюдаемые после введения рандомизированных образцов медетомидина и ксилазина у клинически здоровых собак и кошек на основании данных физиологического мониторинга, проводимого в интраоперационных условиях.
Материалы и методы
Перед началом проведения исследовательской работы флаконы с препаратом, содержащим агонист альфа2-адренорецептора: медетомидин или ксилазин предварительно рандомизировали. Для интерпретации полученных результатов, при обработке готовых данных группа животных, которым применяли образец, содержащий ксилазин – была обозначена как группа 1 (к), а медетомидин – группа 2 (м) соответственно. Согласно общепринятым рекомендациям по применению агонистов альфа2-адренорецепторов в анестезиологии животных из исследования были исключены особи, имеющие в анамнезе поражение почек, печени и сердечно-сосудистые патологии, а также животные старше 8 лет по этическим мотивам, а также во избежание неоправданного риска. Животных подбирали в группы по принципу пар-аналогов (различия не более 10 – 20 %). Образец препарата, содержащего 0,1% медетомидина гидрохлорида был предоставлен ООО НПО «Апи-Сан», Россия. В качестве опытного образца препарата, содержащего ксилазин в 0,2% концентрации, использовали препарат, произведенный компанией Interchemie Werken «de Adelaar» BV. Подготовленные образцы были переданы в многопрофильный ветеринарный центр «Астин», Московская обл. для проведения исследования в трех подразделениях компании.
Анестезиологический предоперационный осмотр проводили согласно принятым методикам, руководствуясь оценкой пациентов по шкале Американского Общества Анестезиологов (ASA) от 1 (клинически здоровый) до 5 (в критическом состоянии) [5]. Всего в исследовании участвовало 93 особи, из них 68 кошек и 25 собак обоего пола. Для индукции применялся пропофол 1%, при болезненных операциях для обеспечения анальгезии проводилась анестезия с лидокаином гидрохлоридом 2% в эпидуральное пространство, для осуществления гипнотического эффекта и поддержания анестезии применяли изофлюран, в других случаях — смесь тилетамина гидрохлорида и золазепама гидрохлорида в ИПС.
Для мониторинга анестезиологического пациента применялись монитор пациента IM-10 или IM-12, Zoomed, наркозно-дыхательный аппарат DIXION Практик 3000, УЗ-аппарат Mindray DC-N6 и Mindray DC-N7 для кардиологического обследования, портативный ветеринарный тонометр марок PetMap Graphic и PetMap Graphic II.
Регистрацию данных состояния животного во время анестезии проводили на: 0 (предоперационных период) мин, 15 мин, 30 мин и 45 мин. Статистическую обработку данных проводили по методике Стьюдента с применением пакета программного обеспечения Microsoft Office Excel 2013. Во всех процедурах статистического анализа p>95.
Результаты и обсуждение
Образцы препаратов с ксилазином и медетомидином применяли согласно утвержденной инструкции. Независимо от пола и вида, в среднем для обеспечения необходимого уровня седации во время операции потребовались следующие дозы агонистов альфа2-адренорецепторов: в группе 1 (к) — 974,95± 140,07 мкг/кг массы тела и в группе 2 (м) — 45,81±5,35 мкг/кг (Рис 1.)
Рис. 1 Средние дозы препаратов агонистов альфа2-адренорецепторов, используемые для премедикации животных по ДВ.
При этом для животных, находящихся в состоянии гипервозбуждения (стресс, агрессия) дополнительное введение агониста альфа2-адренорецептора не потребовалось, что опровергает устойчивое утверждение, что для высоко возбудимых животных требуется дополнительное введение седативного препарата в премедикации.
Наибольшую клиническую значимость при интраоперационном физиологическом мониторинге пациентов представляют кардиоваскулярные эффекты во время анестезии при использовании агонистов альфа2-адренорецепторов. Оценить степень депрессивного влияния на миокард позволяет нам параметр фракции сократимости (ФС). В таблице 1 приведены данные по измерению параметра в первые 15 минут операции.
Таблица 1. Измерение ФС в группах (М±m, p>95)
| Параметры | Группа 1 (к) | Группа 2 (м) | ||
| 0 мин | 15 мин | 0 мин | 15 мин | |
| ФС: собаки | 46,95± 3,22 | 35,57± 4,16 | 42,47± 5,99 | 25,83± 3,54 |
| ФС: кошки | 49,78± 2,77 | 31,14±4,14 | 50,07± 2,48 | 29,18± 2,53 |
Как мы видим из данных таблицы 1, ФС у собак и кошек снижается как в группе, получавшей медетомидин гидрохлорид так и в группе животных, седированных ксилазином. И первой и во второй группе мы наблюдали среди кошек критически низкие значения ФС <15 через 15 минут после инъекции. Можно сделать предположение, что кошки более чувствительный вид, кроме того, чем ниже исходное значение ФС у животных, тем выше вероятность критического падения этого параметра и проявления так называемого «смоки эффекта». Влияние альфа2-агонистов на сократимость и сердечный выброс были описаны также в [9,12,17,18]. Также было доказано, что снижение сердечного выброса при применении альфа2-агонистов никоим образом не влияет на перфузию жизненно-важных органов у животных [17]. Механизм этого явления (снижение ФС) до сих пор не достаточно изучен, но считается, что депрессивное влияние селективных альфа2-агонистов на сердце можно снять введением атипамезола [6]. Также отмечаем, что случаев развития атриовентрикулярных блокад I и II в опытных группах мы не выявляли [18].
Альфа2-агонисты замедляют сердечные сокращения [6]. В опытных группах через 15 минут после инъекции снижение ЧСС было на 18,5-33,3%, что вполне укладывалось в физиологические параметры для вида.
Альфа2-агонисты оказывают периферическое действие на адренорецепторы в гладкой мускулатуре сосудов, вызывая вазоконстрикцию. Резкое увеличение периферического сосудистого сопротивления оказывает нагрузку на миокард. По некоторым данным [19] введение альфа2-агонистов не оказывает существенного негативного влияния на величину артериального давления (Таблица 2).
Таблица 2. Измерение величины АД, мм рт. ст. в группах (М±m, p>95)
| Группы | 0 мин, АД с/д | 15 мин, АД с/д | 30 мин, АД с/д | |||
| Группа 1 (к) | 175,55± 9,75 | 110,42± 6,75 | 150,33± 11,25 | 100,36± 10,44 | 139,03± 9,39 | 89,64± 6,66 |
| Группа 2 (м) | 175,95± 11,62 | 108,23± 8,55 | 168,35± 10,08 | 112,56± 8,41 | 158,10± 10,71 | 108,12± 10,39 |
В группе 1 (к) дельта изменений АД характеризовалось большим значением, чем в группе 2 (м): на 15 минуте АД систолическое снизилось на 14,36% по отношению к исходному значению, измеренному в предоперационный период, а в группе 2 (м) лишь на 4,32%. Хотя, как мы видим, параметры АД в предоперационном периоде практически идентичны в группах. Параксизмально резкое повышение АД (кратковременная гипертония) ˃ 200 мм. рт. ст. определяли лишь у 4 кошек из группы 1 (к) на 15 минуте и у 3 кошек и 1 собаки в группе 2 (м). Обратное гипертонии – гипотензия (<60-80 мм рт. ст.) не наблюдали у опытных животных на протяжении всего периода наблюдения.
Известно, что у седированных животных замедляется частота дыхательных движений (ЧДД), степень дыхательной депрессии прямо пропорциональна дозе вводимого альфа2-агониста [8,10]. Сравнение показателей ЧДД в группах на Рис.2.
Рис. 2 Мониторинг изменения ЧДД
Снижение величины ЧДД через 15 минут после премедикации (Рис. 2) у животных из группы 1 (к) более резкое, в группе 2 (м) – плавное, обусловленное введением пропофола, угнетающего дыхательный центр в гипоталамусе. Во время проведения анестезии — апное наблюдали у 1 кошки в группе 1(к), в группе 2(м) случаев остановки дыхания не было. Не отмечали для альфа2-агонистов в группах эффекты гипоксемии и цианоза у животных. Оксигенация (SpO2) не опускалась ниже <89% во время операции. Определение скорости наполняемости капилляров после их сдавливания в ротовой полости не выявило статистически значимых отклонений в группах.
Во время выполнения хирургических манипуляций у анестезированных животных не редко можно определить гипотермию. Чаще у маловесных особей, теряющих тепло быстрее. Результаты измерения t°C тела животных до и во время анестезии в таблице 3.
Таблица 3. Термометрия животных в группах (M±m, p>95)
| Время, мин | 15 | 30 | 45 | ||
| Группы | |||||
| Группа 1 (к) кошки | 38,49±0,14 | 37,96±0,26 | 37,75±0,28 | 37,62±0,29 | |
| Группа 1 (к) собаки | 38,49±0,26 | 37,88±0,33 | 37,76±0,28 | 38,07±0,40 | |
| Группа 2 (м) кошки | 38,54±0,16 | 38,24±0,20 | 37,80±0,21 | 37,05±0,33 | |
| Группа 2 (м) собаки | 38,68±0,32 | 37,95±0,46 | 37,54±0,33 | 37,6±0,90 |
Снижение температуры тела животного <38°С определяют, как гипотермию. На 15 минуте как видно из таблицы в группе 1 (к) собаки и кошки перешли этот рубеж, в то время как температура тела кошек в группе 2 (м) оставалась чуть выше пороговых 38°С. К 30 минуте у животных первой и второй групп диагностировали слабую гипотермию и для животных использовали грелку.
Визуально во время проведения операций фиксировали появление у животных рвоты, тремора или возбуждения во время премедикации, индукции или на выходе из анестезии.
Как видно на Рис. 3 основные побочные эффекты агонистов альфа2-адренорецепторов – медетомидина и ксилазина сходны, однако большое значение имеет вероятность и частота развития тех или иных нежелательных клинических эффектов у животных во время анестезии. В группе 1 (к) случаи рвоты, тремора, возбуждения и гипотермии встречались чаще.
В целом, как и следовало ожидать медетомидин и ксилазин как агонисты альфа2-адренорецепторов оказывали сходное влияние на организм животных. Однако, нельзя не отметить, что для достижения одного и того же уровня седации, нагрузка на организм животного, которому применяли медетомидин в 20 раз меньше, чем при применении ксилазина. С некоторыми нежелательными эффектами пришлось столкнуться в 3 раза чаще при применении ксилазина. Хотя тремор, возбуждение и рвота не являются угрожающими состояниями для животного. Мониторинг пациентов по основным жизненно важным параметрам не выявил грубых отличий в воздействии ксилазина и медетомидина на организм животных, однако для последнего характерна большая «плавность» и постепенность индуцированных им изменений, без выраженных колебаний и отклонений, что может говорить о лучшей управляемости и контролируемости процесса индукции и выхода из анестезии.
К агонистам альфа — адренергических рецепторов относятся: клонидин , гуанфацин, тизанидин. Эти препараты используются в кардиологии и неврологии, но также представляют интерес и для психиатрии.
Клонидин в качестве альфа — 2 агониста обладает потентностью к 2А, 2В, 2С рецепторам. Эти адренорецепторы широко распространены в центральной нервной системе: альфа 2А и альфа 2С — в большей степени в центральной нервной системе , а альфа — 2В — в периферической ( сердце, легкие, печень, почки). При стимуляции этих пресинаптических рецепторов ( альфа — 2А и альфа — 2С) , он одновременно ингибирует ( подавляет) выделение норэпинефрина, снижая тонус симпатической вегетативной неврной системы , снижает артериальное давление и урежает частоту сердечных сокращений. Седация и анальгезия достигаются за счет влияния на альфа — 2 А рецепторы., в то время как периферические альфа — 2В рецепторы вызывают васкулярную констрикцию. Препарат также способен снижать уровень ренина в плазме крови и усиливать выделение эксрецию катехоламинов. Гипертензия и абстинетный синдром ослабевают в своей выраженности уже через два часа после приема препарата, синдром бесспокойных ног — через несколько дней, а синдром Жиль де ла Туретта — на протяжении недель и месяцев. Побочные эффекты от приема препарата: гипотензия и седация. Реже отмечаются : сухость во рту, слабость, головокружение, ночные кошмары , тошнота, депрессия. Средние дозы препарата : 0,1- 0,8 мг./ день, разделяются на два приема. Также применяется трансдермальный пластырь 0,1-0,3. мг. Лечение гипертонии начинают со стартовой дозы — 0,05 — 0,1 мг. два раза в день, увеличивая по 0,1 мг. / день, увеличивая на 0,1 мг. еженедельно. Клонидин может редуцировать эффективность леводопы, не стоит сочетать клонидин с бета — блокаторами и препаратами дигиталиса Не назначается пациентам с заболеваниями сосудов сердца, после инфаркта миокарда и нарушениями мозгового кровобращения.
Клонидин ( катапрес, диксарит , клорпрес ) применяется в кардиологии для лечения артериальной гипертензии и , в частности, необходимости быстрого снижения артериального давления ( диуретики и гипотензивные средства могут вызвать при одновременном назначении с клонидином ортостатический коллапс) . В детской психиатрии он используется при синдроме повышенной двигательной активности и плохой концентрации внимания ( ADHD) , а в наркологии — при купировании абстинентного синдрома , лечении табакокурения. Клонидин также назначается при выраженном болевом синдроме у онкологических больных. В неврологии препарат применяется при синдроме Жиль де ла Туретта, тиках, нейропатических болях, синдроме бесспокойных ног ( агонисты дофамина более эффективны, а клонидин часто назначается в качестве адъювантной терапии). В эндокринологии клонидин используется при задержке роста, в гастоэнтерологии — при язвенном колите, асците, гипергидрозе., в анестезиологии — в качестве премедикации, в гинекологии — при менопаузе.
Гуанфацин ( тенекс) является центральным агонистом альфа 2 А — адренорецепторов, редуцирует симпатическую активность на выходе из центральной нервной системы, урежает частоту сердечных сокращений, уменьшает периферическую васкулярную резистентность и снижает артериальное давление. В основном применяется при синдроме гиперактивности и плохой концентрации внимания, а также при гипертензии. Также используется при купировании абстинентного синдрома после опиатов и терапии синдрома посттравматического стрессового расстройства. Из опасных порбочных эффектов следует отметить: гипотензию, брадикардию, синкопальные состония. Быстрое отмена опиатов может привести к ребоинд — эффекту , проявляющемуся гипертензией и увеличением катехоламинов в плазме крови. Препарат назначают в дозе ),5 — 2 мг. два раза в день.
Тизанидин ( занафлекс, сирдалут) является центральным альфа — 2 — адренергическим агонистом, в большей степени влияющим на альфа 2 А рецепторы и мышечным релаксантом. Препарат применяется при перемежающемся повышении мышечного тонуса и спазма мышц, также используется для профилактики мигрени , снятия миофасциальной боли, терапии тригеменальной невралгии, болевом синдроме при шейном остеохондрозе. Альфа — 2А и имидазолин рецепторы вовлечены в супраспинальный тормозной ( подавляющий) эффект на моно или поли синаптические рефлексы , тем самым ослабляя выраженность спазма мышца. Вследствие вышесказанного, применяется при рассеянном склерозе и боковым амиотрофическом склерозе., первичном боком склерозе, травмах спинного мозга. В качестве альфа 2А агониста тамкже усиливает пресинаптическое торможение в сером пятне , сером веществе периакведуктального пути, парабрахиальных ядер ( анестетический эффект). Тизанидин проявляет свое действие в течении нескольких часов или недель. Необходима медленная титрование дозы. Из серьезных побочных эффектов следует отметить : брадикардию, пролонгацию QT . Тизанидин вызывает седацию ( пик седации проявляется через несколько недель) и небольшое увеличение веса. Обычные дозы препарата 6-24 мг / в день , разделенные на 3-4 приема, терапию начинают с 2 мг., увеличивая дозу каждые 3-4 дня на 2-4 мг.