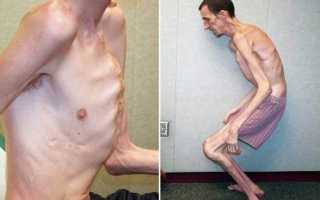
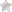Транзигорная неонатальная миастения
Неонатальная миастения диагностируется у детей, матери которых страдают миастенией. Признаки заболевания – резко выраженная гипотония мышц, слабый голос, частое поверхностное дыхание, трудности с сосанием.

Детская миастения раннего возраста развивается до 1-2 лет жизни, поражая чаще всего глазодвигательные мышцы. Тем не менее, патологические процессы могут затронуть мимические и жевательные мышцы.
Какие меры предосторожности необходимо соблюдать при проведении хирургических вмешательств, требующих общей анестезии, у пациентов с миастенией и МСЛИ?
Необходимо учитывать большую длительность действия миорелаксантов у пациентов с миастенией и МСЛИ. Предпочтительно использовать недеполяризу-ющие короткодействующие миорелаксанты в минимальных дозах. Если прекращение приема стероидов невозможно, эквивалентную дозу кортикостероидов вводят внутривенно. Полезна дополнительная доза кортикостероида во время хирургического вмешательства. Проведения антихолинэстеразной терапии во время хирургического вмешательства обычно не требуется, но ее начинают при необходимости после операции, когда пациент приходит в сознание. Необходимо учитывать неэквивалентность доз антихолинэстеразных препаратов при их назначений внутрь и парентерально
Важно поддерживать нормальный уровень в сыворотке натрия, калия, кальция, фосфора и магния. Для уменьшения лекарственных осложнений следует избегать использования препаратов, не являющихся необходимыми, особенно таковых, которые могут ухудшить нервно-мышечную передачу.
Диагностика
Диагноз ставится с помощью исследования нервной проводимости (NCS) и электромиографии (EMG), которая является одним из стандартных тестов при исследовании необъяснимой мышечной слабости. ЭМГ включает введение маленьких игл в мышцы.
NCS – подача небольших электрических импульсов на нервы, на поверхность кожи и измерение электрического ответа рассматриваемой мышцы. Исследование NCS включает оценку сложных двигательных потенциалов действия (CMAP) пораженных мышц.
CMAP показывают малые амплитуды, но нормальные задержки и скорости проводимости. Если вводятся повторные импульсы (2 в секунду или 2 Гц), это нормально для амплитуд CMAP, так как ацетилхолин истощается. При миастеническом синдроме это уменьшение больше, чем обычно.
При LEMS, в ответ на тренировку мышц, амплитуда CMAP значительно увеличивается (более 200%, часто гораздо больше). Это происходит при введении быстрого импульса электрических стимулов (20 импульсов в секунду. 10 секунд).
Назначаются анализы крови, чтобы исключить другие причины мышечного заболевания (повышенная креатинкиназа указывает на миозит, аномальные функции щитовидной железы на тиреотоксическую миопатию). Антитела против потенциал-управляемых кальциевых каналов выявляются у 85% людей с ЭМГ-подтвержденным миастеническим синдромом.
После того, как LEMS диагностирован, такие исследования, как компьютерная томография грудной клетки, проводятся для выявления возможных опухолей легких. 50–60% из них обнаруживаются сразу после постановки диагноза миастении. Остальная часть диагностируется позже, обычно в течение двух – четырех лет.
Сканирование повторяется каждые шесть месяцев первые два года после постановки диагноза. КТ легких обычно адекватна, позитивная эмиссионная томография тела выполняется для поиска скрытой опухоли, особенно легкого.
Лечение синдрома
При наличии паранеопластического генеза этого редкого аутоиммунного заболевания лечение основывается на ликвидации опухолевых процессов. Если терапия опухоли проходит успешно, то, как правило, наблюдают регресс симптоматики. В случае аутоиммунного генеза заболевания проводят симптоматическую терапию фармацевтическими препаратами, которые угнетающе воздействуют на иммунную систему. В основном используют, как уже отмечалось выше, глюкокортикостероиды. Хороший эффект демонстрируется плазмаферезом, позволяющим отфильтровывать из крови аутоантитела, которые в ней циркулируют.
В целях облегчения мышечного проведения в схему терапии включаются ингибиторы ацетилхолинэстеразы, выступающие фармацевтическими препаратами, облегчающими нервную передачу посредством накопления ацетилхолина в синапсе. К таким препаратам относят «Пиридостигмин» с «Ипидакрином». В ряде ситуаций отмечается улучшение при использовании «Гуанидина», который облегчает высвобождение ацетилхолина с помощью нервных окончаний.
Правда, «Гуанидин» не нашел широкого применения вследствие большой токсичности с побочным эффектом на почки и костный мозг. Менее токсичным лекарственным препаратом с похожим эффектом выступает «Диаминопиридин». Его применение может сопровождаться появлением парестезии, диареи, повышенной бронхиальной секреции и тахикардии. Несмотря на то что эффективность этого лекарства была доказана клинически, на сегодняшний день оно используется только в медицинских специализированных центрах. Далее поговорим о методах профилактики.
Объясните механизм нарастающего ответа после высокочастотной повторяющейся стимуляции нерва у пациентов с МСЛИ
Уменьшение входящего тока Са2+ в пресинаптическое нервное окончание (вследствие воздействия антител) приводит к недостаточному высвобождениюацетилхолина. При стимуляции нерва с достаточно высокой частотой (вследствие внешней высокочастотной повторяющейся стимуляции нерва или кратковременной физической нагрузки) повторяющаяся деполяризация нерва приводит к частому вхождению кальция, что превосходит возможности системы, выводящий кальций из клетки. В результате уровень внутриклеточного кальция временно увеличивается, а вместе с этим нормализуется процесс высвобождения АХ, что приводит к драматическому увеличению амплитуды суммарного мышечного потенциала действия. Тем не менее низкочастотная стимуляции нерва приводит к снижению амплитуды мышечного потенциала действия, что можно спутать с декрементом при миастении.
Симптомы
Главный симптом, который отличает синдром Ламберта от обычной миастении — локализация. В первом случае страдают нижние конечности, тогда как при обычном типе недуга в зоне поражения находится весь организма.
Помимо слабости и чрезмерной утомляемости, существуют и другие признаки, в том числе:
- снижение потоотделения и слюнотечения;
- ортостатическая гипертензия;
- отсутствие реакции зрачков на свет;
- эректильная дисфункция у мужчин;
- снижение остроты зрения;
- двоение в глазах;
- изменение тембра голоса и дикции (появление гнусавости и утрата четкости речи);
- болезненные ощущения при глотании;
- проблемы с дыханием;
- тахикардия;
- нарушения в системе желудочно-кишечного тракта (ЖКТ).
Постепенно, больной начинает испытывать проблемы с ходьбой, появляется шаткость в походке, появляются трудности с подъемами по лестнице. Могут проявиться болевые ощущения в шее и спине.
Кроме того, больной начинает испытывать проблемы со вставанием, со стула или постели. Как правило, ему это стоит серьезных мышечных усилий.
При данном недуге может развиться холинергический криз, который имеет симптоматику, противоположную синдрому Итона Ламберта, в частности:
- сокращение ритма сердцебиения;
- сужение зрачков;
- повышение неконтролируемого слюнотечения;
- повышенная секреция бронхиальной слизи.
При наличии подобных признаков больного необходимо немедленно доставлять в больницу, так как это опасно не только для его здоровья, но и для жизни.
Описание синдрома
Наиболее часто причиной возникновения синдрома является мелкоклеточный рак легких. Очень часто при развитии данного заболевания пациенты жалуются на появление офтальмоплегия, слабость. Причиной возникновения этой болезни очень часто выступают аутоиммунные болезни и образования злокачественного характера.
Часто болезнь развивается в проксильных мышцах нижних конечностей. При этом у пациентов наблюдается уменьшение отделения слюны, слез и пота. Наиболее часто данным заболеванием страдают представители мужского пола. Больным очень трудно вставать из положения лежа или сидя. Иногда бывает, что мышцы напрягаются произвольно, что приводит к улучшению их работоспособности. Очень часто наблюдается развитие вегетативной дисфункции.
Синдром Итона-Ламберта относится к категории достаточно сложных заболеваний, которые сопровождаются большим количеством характерных синдромов. Лечение болезни производится в стационаре.
Причины
Синдром Итона-Ламберта может быть врожденный или приобретенный. Заболевание в большинстве случаев возникает из-за мутации генов белков, которые отвечают за мышечные сокращения.
Синдром Итона-Ламберта очень часто наблюдается у молодых людей. Причиной возникновения заболевания в этом возрасте является опухолевый процесс в тимусе. В этом случае осуществляется удаление пораженного органа хирургическим путем.
В некоторых случаях наблюдается приобретение болезнью аутоиммунного характера. В результате развития болезни наблюдаются антитела в области мышц и тимуса. Данное заболевание очень часто возникает в результате перенесенных стрессов. Синдром Итона-Ламберта возникает из-за нарушения работы иммунитета.
После 40 лет заболеванием страдают примерно одинаково, как мужчины, так и женщины. В педиатрии синдром встречается очень редко. Дети, которые страдают данным заболеванием, составляют от 1 до 3 процентов.
Признаки

У большинства пациентов верхнее веко опускается. Синдром Итона-Ламберта очень часто сопровождается снижением остроты зрения.
Также при развитии заболевания наблюдаются такие симптомы:
- Появление диареи или запора.
- Нарушается дыхание.
- Учащается сердцебиение.
- Появляется гнусавость и т. д.
При осмотре пациента доктором наблюдается наличие признаков дизартрии. В определенной группы пациентов при данном заболевании сужаются зрачки. Также больные жалуются усиление слюноотделения, которое появляется спонтанно. При развитии болезни внезапно замедляется частота сокращений сердца. Перистальтика кишечника в этот период активируется, что негативно отражается на самочувствии пациента. Объем секреции бронхов при синдроме Итона-Ламберта увеличивается.
После длительного отдыха и сна улучшений у пациента не наблюдается. При развитии данного заболевания наблюдается изменения голоса.
Благодаря очень развитой симптоматике болезни ее достаточно просто определить при использовании соответствующей диагностики. Это позволит доктору назначить рациональное лечение.
Врожденные миастенические синдромы
Симптом врожденной миастении – слабое шевеление плода. Чаще всего диагностируется у мальчиков, они болеют вдвое чаще, чем девочки, однако сама врожденная форма болезни встречается нечасто.
При врожденных синдромах поражаются в первую очередь глазодвигательные мышцы (офтальмоплегия). У новорожденного обнаруживается неподвижность или ограниченная подвижность глаз. Ребенок не переводит взгляд, не ищет мать, повернув голову на ее голос. Это выявляется в первые недели жизни малыша.

Известна разновидность миастенического синдрома, при которой сочетаются мышечная гипотония и недоразвитие синаптического аппарата. Встречается реже других, не поддается лечению. У больных наблюдаются аномалии развития скелета, асимметрия форм лица, тела, у девочек – недоразвитие грудных желез.
Помимо этих видов, существуют еще ряд миастенических синдромов, связанных работой ионных каналов, с недоразвитием синаптического аппарата, с приёмом антибиотиков и т.д. Но они не настолько распространеные.
Синдром Ламберта-Итона: причины и факторы риска
Причины возникновения синдрома Ламберта-Итона составляют две группы пациентов: с одной стороны, синдром Ламберта-Итона встречается примерно в 40 процентах случаев без видимой причины (идиопатический). С другой стороны, примерно в 60% случаев это связано с раком (паранеопластическое) – особенно мелкоклеточный бронхиальный рак. Аналогично, синдром Ламберта-Итона может возникать при раке крови, таком как лейкоз. Диагноз синдрома Ламберта-Итона может предшествовать диагнозу рака по месяцам или даже годам. В единичных случаях рак был обнаружен только через пять лет.
Антитела нарушают передачу сигналов от нервов к мышцам
Для сокращения (сокращения) мышцы электрохимический сигнал должен передаваться от нерва к мышце. Это происходит на так называемой концевой пластине двигателя (Synapse). Когда электрический стимул достигает нервного конца в синапсе, кальций течет через определенные кальциевые каналы в нервах. Этот приток кальция в нервные окончания вызывает высвобождение мессенджера ацетилхолина из нерва. Ацетилхолин проходит через разрыв между нервными окончаниями и мышцей (синаптическая щель) и активирует специальные места стыковки на мембране мышечных клеток. При синдроме Ламберта-Итона эта передача сигналов от нерва к мышце нарушается.
Причина этого в том, что у людей с синдромом Ламберта-Итона в крови циркулируют определенные антитела. Эти антитела разрушают часть кальциевых каналов, упомянутых выше. Это приводит к уменьшению притока кальция и, следовательно, к уменьшению выделения ацетилхолина. Таким образом, нормальная передача сигнала ослабляется. Поскольку не все кальциевые каналы разрушены, контакт между нервной системой и мышцами не полностью прерван, но решительно нарушен.
Паранеопластический синдром Ламберта-Итона: раковые клетки образуют кальциевые каналы
Причина образования аутоагрессивных антител против кальциевых каналов до сих пор не выяснена. Однако ясно, что раковые клетки также имеют кальциевые каналы на своей поверхности. На раковых клетках мелкоклеточной бронхиальной карциномы были обнаружены точно такие же каналы, как и на моторной концевой пластине. По этой причине ученые предполагают, что иммунная система вырабатывает антитела против этих кальциевых каналов для защиты от рака. Однако, поскольку эти каналы также встречаются в области концевой пластины двигателя, иммунодефицит может вызвать вышеописанное нарушение передачи сигнала в случае рака. Эта гипотеза также может объяснить, что успешная борьба с раком в то же время значительно улучшает течение синдрома Ламберта-Итона.
Идиопатический синдром Ламберта-Итона: дезадаптированная иммунная система
До сих пор неясно, почему это может происходить независимо от рака (и, следовательно, без видимой причины) синдрома Ламберта-Итона. Ученые подозревают, что у людей с идиопатическим синдромом Ламберта-Итона иммунная система обычно не регулируется. Эта теория основана на том факте, что у других людей с идиопатическим синдромом Ламберта-Итона часто образуются другие аутоагрессивные антитела, что приводит к так называемым аутоиммунным заболеваниям. Эти заболевания, обычно связанные с синдромом Ламберта-Итона, включают тиреоидит Хасимото (аутоиммунный тиреоидит, красная волчанка и ревматоидный артрит).
Кроме того, исследования показали, что определенные генетические факторы также играют роль у пациентов с идиопатическим синдромом Ламберта-Итона. Например, генетические особенности HLA-B8, HLA-DR3 и ген DQ2 более распространены. Эти гены обнаруживаются при многих заболеваниях, которые вызваны аутоагрессивными процессами иммунной системы (аутоиммунитет). Поэтому объяснение аутоиммунных заболеваний, таких как синдром Ламберта-Итона, может быть в генетической структуре пораженных.
Взаимодействие с наркотиками
Лекарства могут также влиять на начало и серьезность синдрома Ламберта-Итона: ряд обычно используемых лекарств может ухудшить симптомы синдрома Ламберта-Итона. К ним относятся лекарства, которые используются в анестезии, а также некоторые антибиотики и бензодиазепины, такие как диазепам. По этой причине каждое использование лекарств у пациентов с синдромом Ламберта-Итона должно быть тщательно проверено. Каждый лечащий врач должен быть проинформирован о наличии заболевания.
Диагностика и методы исследования
Диагностика синдрома Ламберта-Итона включает в себя несколько методов исследования, которые позволяют определить наличие и причины возникновения этого состояния.
Один из основных методов — это электромиография (ЭМГ). При этом обследовании записывается активность мышц при выполнении различных движений. Аномальные результаты ЭМГ могут указывать на наличие синдрома Ламберта-Итона.
Также проводятся лабораторные исследования, включая анализ крови на наличие антител к никотиновым рецепторам. Высокий уровень таких антител может означать наличие аутоиммунного процесса, который может быть связан с синдромом Ламберта-Итона.
Для дополнительной оценки исследуется функция нервной системы с помощью неврологического обследования и других методов, таких как электроэнцефалография (ЭЭГ), магнитно-резонансная томография (МРТ) и компьютерная томография (КТ).
Исследование функции легких с помощью спирометрии может быть полезным, так как синдром Ламберта-Итона может приводить к дыхательной недостаточности.
Важным этапом диагностики является исключение других возможных причин симптомов, таких как миастения гравис, амиотрофический боковой склероз или другие нейромускулярные заболевания. Для этого может потребоваться консультация нескольких специалистов, включая невролога, нейрофизиолога, пульмонолога и ревматолога.
| Метод исследования | Описание |
|---|---|
| Электромиография (ЭМГ) | Изучение электрической активности мышц |
| Лабораторные исследования | Анализ крови на наличие антител к никотиновым рецепторам и другие маркеры |
| Неврологическое обследование | Оценка функции нервной системы и других нейромускулярных структур |
| Электроэнцефалография (ЭЭГ) | Измерение электрической активности мозга |
| Магнитно-резонансная томография (МРТ) | Изображение структур мозга с помощью магнитного поля и радиоволн |
| Компьютерная томография (КТ) | Изображение структур тела с помощью рентгеновского излучения и компьютерной обработки |
| Спирометрия | Измерение объема и скорости дыхания |
Механизм
При нормальной нервно-мышечной функции нервный импульс переносится по аксону (длинная проекция нервной клетки ) от спинного мозга . В нервном окончании в нервно-мышечном соединении , где импульс передается мышечной клетке, нервный импульс приводит к открытию потенциалозависимых кальциевых каналов (VGCC), притоку ионов кальция в нервное окончание и кальций зависимый запуск слияния синаптических пузырьков с плазматической мембраной. Эти синаптические пузырьки содержат ацетилхолин , который попадает в синаптическую щель и стимулирует рецепторы ацетилхолина в мышцах. Затем мышца сокращается.
В LEMS антитела против VGCC, особенно VGCC P / Q-типа , уменьшают количество кальция, который может попасть в нервное окончание, поэтому меньше ацетилхолина может высвобождаться из нервно-мышечного соединения. Помимо скелетных мышц , вегетативная нервная система также требует нейротрансмиссии ацетилхолина; это объясняет возникновение вегетативных симптомов в LEMS. В мозжечке также обнаружены потенциалозависимые кальциевые каналы P / Q , что объясняет, почему у некоторых возникают проблемы с координацией. Антитела связываются, в частности, с частью рецептора, известной как «линкерный пептид домена III S5 – S6». Антитела могут также связывать другие VGCC. У некоторых есть антитела, которые связывают синаптотагмин , белковый сенсор для регулируемого кальцием слияния везикул. Многие люди с LEMS, как с антителами к VGCC, так и без них, имеют обнаруживаемые антитела против подтипа M1 рецептора ацетилхолина ; их присутствие может участвовать в отсутствии компенсации слабого притока кальция.
Помимо снижения притока кальция, также происходит нарушение участков высвобождения везикул в активной зоне, что также может быть антителозависимым, поскольку люди с LEMS имеют антитела к компонентам этих активных зон (включая потенциал-зависимые кальциевые каналы). Вместе эти аномалии приводят к снижению сократимости мышц. Повторяющиеся стимулы в течение примерно 10 секунд в конечном итоге приводят к достаточной доставке кальция и увеличению мышечного сокращения до нормального уровня, что можно продемонстрировать с помощью исследования электродиагностической медицины, называемого игольчатой электромиографией, путем увеличения амплитуды повторяющихся потенциалов действия сложных мышц .
Антитела, обнаруженные в LEMS, связанные с раком легких, также связываются с кальциевыми каналами в раковых клетках, и предполагается, что изначально антитела развиваются как реакция на эти клетки. Было высказано предположение, что иммунная реакция на раковые клетки подавляет их рост и улучшает прогноз рака.
Патогенез
В основе патогенеза заболевания лежит выработка аутоантител, триггером которых чаще является опухолевый процесс в организме. Доказано, что мелкоклеточный рак легкого имеет антигены схожие по структуре с холинергическими терминалями нейронов. Вследствие перекрестных иммунологических реакций вырабатывается широкий спектр антител к потенциально зависимым кальциевым каналам, локализованных в пресинаптической мембране синапса. Аутоантитела нарушают механизм высвобождения ацетилхолина в синаптическую щель, что приводит к блокаде проведения импульса.
В литературе отмечены случаи выработки антител к белку синаптотагмин-1, отвечающий за экзоцитоз кальциевых рецепторов, и пресинаптическим мускариновым (M1) ацетилхолиновым рецепторам, усиливающим холинергическую передачу.
История
Андерсон и его коллеги из больницы Святого Томаса в Лондоне первыми упомянули случай с возможными клиническими находками LEMS в 1953 году, но Ламберт, Итон и Рук из клиники Мэйо были первыми врачами, подробно описавшими клинические и электрофизиологические результаты. болезни в 1956. В 1972 году объединение LEMS с другими аутоиммунными заболеваниями привело к гипотезе о том, что это вызвано аутоиммунитетом. Исследования 1980-х годов подтвердили аутоиммунную природу, а исследования 1990-х годов продемонстрировали связь с антителами против потенциалзависимых кальциевых каналов P / Q-типа.
Лечение миастенического синдрома Ламберт-Итона
Это условие невозможно излечить. Вы будете работать со своим врачом, чтобы управлять любыми другими состояниями, такими как рак легких.
Ваш врач может рекомендовать лечение внутривенным иммуноглобулином (IVIG). Для этого лечения ваш врач будет вводить неспецифическое антитело, которое успокаивает иммунную систему. Другое возможное лечение – плазмаферез. Кровь удаляется из организма, и плазма отделяется. Антитела удаляются, и плазма возвращается в организм.
Наркотики, которые работают с вашей мышечной системой, иногда могут облегчить симптомы. К ним относятся местинон (пиридостигмин) и 3,4 диаминопиридин (3,4-DAP).
Эти лекарства трудно получить, и вы должны поговорить со своим врачом, чтобы узнать больше информации.
Симптомы и диагностика
Основа симптоматики – повышенная утомляемость и слабость определенной группы скелетных мышц.
Помимо этого клиническая картина синдрома характеризуется следующими проявлениями:
- Слабость в ногах, отсутствие устойчивости, особенно при подъеме по лестнице и длительной ходьбе.
- Дискомфорт в зоне шеи и спины, развитие миалгии.
- Периферические парестезии.
- Понижение сухожильных рефлексов.
- Иногда может ощущаться болезненность в мышцах проксимальных отделов нижних конечностей.
- Опущение верхнего века.
- Нарушение походки – характерна «утиная» походка.
- Вегетативные расстройства – сухость во рту, ортостатическая гипотония (резкое снижение АД во время принятия человеком вертикального положения), снижение слюноотделения и потоотделения, чувство ползания мурашек в ногах, запоры, расстройства мочеиспускания, эректильная дисфункция.

Отличительная особенность – нарастание мышечной силы в ходе двигательной активности, после чего наблюдается быстрое ее снижение.
Точнее выяснить симптомы и причины возникновения миастенического синдрома позволяет тщательное обследование с применением различных диагностических методик.
Сначала специалист проводит разбор жалоб пациента и составляет анамнез с учетом таких факторов:
- время появления первых признаков;
- наследственные данные (были ли у ближайших родственников онкология либо синдром Ламберта-Итона);
- наличие ревматического артрита;
- наличие проблем со зрением (двоение в глазах, опущение века).
Далее проводится общий неврологический осмотр, в ходе которого больной выполняет специальные тесты, заключающиеся в повторении определенных движений. Это позволяет выявить возможную слабость мышечной ткани больного.
Для подтверждения диагноза могут назначаться лабораторные и аппаратные диагностические способы:
- Лабораторная методика для определения уровня специфических антител к воздействию ацетилхолиновых рецепторов.
- Электронейромиография – позволяет оценить скорость передачи нервного импульса и степени возбудимости мышц.
- КТ, МРТ – максимально точные методики, позволяющие подтвердить предварительный диагноз.
Поскольку высока вероятность развития патологии на фоне онкологического процесса, то рекомендуется расширенное обследование больного на предмет выявления злокачественной опухоли.
При отсутствии результатов рекомендуется повторно пройти обследование через полгода, поскольку синдром может проявляться за несколько лет до диагностирования первичной онкологии.
Диагностика миастенического синдрома Ламберт-Итона
Для диагностики LEMS ваш врач проведет подробную историю и проведет физическое обследование. Ваш врач будет искать:
- уменьшенные рефлексы
- потеря мышечной ткани
- слабость или проблемы с движением, которые становятся лучше с активностью
Ваш врач может заказать несколько тестов для подтверждения состояния.Анализ крови будет искать антитела против VGCC (антитела против VGCC). Электромиография (ЭМГ) проверяет ваши мышечные волокна, видя, как они реагируют при стимуляции. Маленькая игла вставляется в мышцу и подключается к счетчику. Вас попросят договориться о том, что мышцы, и метр будет читать, насколько хорошо ваши мышцы реагируют.
Другим возможным испытанием является тест скорости проводимости нерва (NCV). Для этого теста ваш врач поместит электроды на поверхность вашей кожи, покрывая основную мышцу. Патчи дают электрический сигнал, который стимулирует нервы и мышцы. Активность, которая возникает из нервов, регистрируется другими электродами и используется, чтобы выяснить, как быстро нервы реагируют на стимуляцию.
Диагностика
Врач-невролог ставит диагноз миастения на основе жалоб, данных анамнеза, осмотра и исследований. Специалист сравнивает жалобы пациента с симптомами, характерными для этой болезни. Для подтверждения диагноза проводят диагностические исследования.
Электронейромиография при миастении является «золотым стандартом» и обязательным исследованием. Используется специальный режим ЭНМГ – «декремент-тест». При проведении обследования с помощью электрической стимуляции исследуемую мышцу заставляют сокращаться с высокой частотой. В результате при миастении или миастеническом синдроме регистрируется уменьшение интенсивности мышечного сокращения.
Прозериновая проба. Выполняется самостоятельно или после проведения декремент-теста. Прозерин — вещество, улучшающее нервно-мышечную передачу. Подкожно вводится небольшое его количество, через 30 минут после этого пациент вновь осматривается врачом или проводится повторная ЭНМГ. Проба считается положительной, если отмечается клиническое улучшение или позитивная динамика при выполнении декремент-теста.
Лабораторная диагностика. Анализ крови на содержание специфических антител к рецепторам, мышцам. Антитела выявляются далеко не во всех случаях миастении.
Как правило, этих методов в сочетании с бывает достаточно для установления диагноза.
Во время осмотра врач может провести пробы на повышенную мышечную утомляемость. Сначала на определенную группу мышц дается нагрузка, затем оценивается их состояние. При глазной форме миастении нагружают глазодвигательные мышцы, для этого больного просят в течение 30 секунд смотреть в одну точку. При жалобах на патологическую усталость мышц шеи, пациента укладывают на спину и просят держать голову поднятой в течение 1 минуты. При слабости в ногах, больному нужно сделать несколько приседаний либо походить на носочках. Для определения степени утомляемости мышц кисти и предплечья, человека просят несколько раз интенсивно согнуть и разогнуть кисть.
Лечение
Хирургическое вмешательство
- Тимэктомия – полное или частичное удаление тимуса при наличии новообразований в этой области. Проводят пациентам не старше 60 лет.
- Возможно воздействие на тимус посредством лучевой терапии.
Медикаментозная терапия
- Антихолинэстразные препараты служат для улучшения проводимости нервных импульсов к мышечным тканям. Количество препаратов, кратность и продолжительность приема зависит от выраженности симптомов и типа болезни.
- Глюкокортикостероиды используются для «торможения» аутоиммунных реакций.
- Калийсберегающие диуретики (позволяют сохранять часть калия в организме) и препараты, содержащие калий. Калий способствует улучшению нервно-мышечной передачи.
- Иммунодепрессанты так же служат для подавления аутоиммунных процессов.
Плазмаферез
Используется для очищения крови от антител к ацетилхолиновым рецепторам. Процедура эффективна не при всех формах миастении. Используется в сочетании с медикаментозным лечением. Процедура замены плазмы (плазмаферез) на донорскую плазму или аналогичные жидкости требует взвешенного подхода, проводится в течение нескольких часов. Требует предварительной консультации врача-трансфузиолога, так как имеется целый ряд противопоказаний.
Таким образом, существуют различные алгоритмы консервативного лечения миастении, которые используются лечащим врачом индивидуально, в зависимости от клинического случая.
Самолечение, самостоятельная коррекция назначенной врачом терапии может привести к ухудшению и даже к смерти. Избыточный прием препаратов может привести к жизнеугрожающему состоянию, развивается холинергический криз. По своим симптомам он схож с миастеническим кризом, который возникает при недостаточно эффективном лечении. Оба состояния требуют наблюдения в условиях реанимации.
Прогноз
При своевременном обращении к специалистам пациент получает эффективное лечение, позволяющее добиться стойкой ремиссии, без обострений и миастенических кризов. А в ряде случаев возможно и полное излечение. Отказ от врачебной помощи может привести к плачевным последствиям.